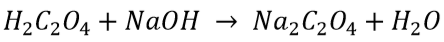PRAKTIKUM I
Reaksi Asam Basa
A. Tujuan
- Menentukam trayek pH berbagai indikator asam basa.
- Menentukan trayek pH berbagai indikator yang terdapat pada tumbuh – tumbuhan.
- Menentukan pH larutan dengan menggunakan indikator asam basa.
- Menentukan pH larutan dengan menggunakanindikator yang terdapat pada tumbuh-tumbuhan.
- Menghitung konsentrasi larutan asam dengan menggunakan larutan standar basa.
B. Prinsip Percobaan
Pada percobaan ini mengenai reaksi asam basa, yang bertujuan untuk menentukan trayek pH berbagai indikator asam basa, menentukan trayek pH dengan indikator yang terdapat pada tumbuh-tumbuhan, menentukan pH larutan dengan menggunakan indikator pada tumbuhan dan asam basa, serta menentukan konsentrasi larutan asam cuka dengan menggunakan larutan standar natrium hidroksida.
Zat-zat dapat diklasifikasikan menjadi asam dan basa didasarkan pada karakteristik zat-zat tersebut di dalam larutan air. Suatu zat dapat dikatakan asam apabila antara lain: mempunyai rasa asam, memerahkan kertas lakmus biru dengan basa bereaksi membentuk grama ditambah air. Sedangkan basa antara lain mempunyai rasa pahit, licin, dan membirukan kertas lakmus merah.
Asam adalah zat yang mengandung hydrogen dan jika dilarutkan dalam air akan terurai menjadi ion hidroksida dan ion hydrogen dan amonioum, sedangkan basa adalah senyawa hidroksida dan ion logam yang dikemukakan oleh Arrhenius.
Pada tahun 1923, Bronsted dan Lowry mengemukakan bahwa asam adalah donor proton, dan basa adalah akseptor proton. Perkembangan selanjutnya oleh Lewis, yaitu asam adalah zat yang dapat menerima pasangan electron, sedangkan basa yang memberikan pasangan elektron.
Pada praktikum kali ini akan dilakukan tiga percobaan, yaitu; penentuan trayek pH indicator asam basa, penentuan pH larutan, dan menentukan konsentrasi larutan asam dengan menggunakan larutan standar basa (titrasi asam basa).
Pada praktikum kali ini akan dilakukan tiga percobaan, yaitu; penentuan trayek pH indicator asam basa, penentuan pH larutan, dan menentukan konsentrasi larutan asam dengan menggunakan larutan standar basa (titrasi asam basa).
- Penentuan Trayek pH Asam Basa
Indikator
asam basa adalah suatu senyawa organik yang dapat berubah warna dengan
berubahnya pH, untuk membedakan asam atau basa. Jenis indikator asam basa
beragam bisa lakmus, larutan indikator, dan indicator alami.
Indikator alami dibuat dari
bahan alam bagian tanaman yang berwarna, misalnya kelopak bunga, bunga asoka,
kunyit, kol merah, dan kulit buah karamunting.
Percobaan ini dilakukan dengan mengujikan larutan dengan larutan pH 1-12 dan masing-masing akan ditetesi dengan berbagai indicator asam basa. Sedangkan untuk indikator alami asam basa menggunakan metode ekstraksi, bahan alami akan ditumbuk menggunakan lumpang dan alu yang ditambahkan dengan alkohol sampai warna bahan terekstrasi sempurna, dan disaring sehingga filtratnya digunakan sebagai indikator.
2. Penentuan pH Larutan
Pada percobaan kedua ini akan dilakukan penentuan pH larutan dengan menggunakan indikator asam basa dan indicator dari ekstrak tumbuh-tumbuhan. Indikator buatan asam basa yang digunakan adalah indikator MO, MM, BTB, PP, kertas lakmus merah, dan kertas lakmus biru. Untuk indikator alami menggunakan ekstrak kembang sepatu, ekstrak kol merah, dan ekstrak kunir. Pada percobaan ini menggunakan larutan HCl, H2SO4, Al2(SO4)3, NaCl, Ca(OH)2, NH4OH, dan Na2CO3. Dilakukan dengan mendekati kertas lakmus ke dalam masing-masing larutan dan untuk ekstrak tumbuh-tumbuhan dengan larutan yang baru, setiap percobaan dilihat perubahan warnanya.
Hasil yang diharapkan adalah larutan asam dapat merubah lakmus biru menjadi berwarna merah dan warna larutan sesuai taryek pH indicator, sedangkan larutan basa dapat merubah lakmus merah menjadi biru dan warna larutan berubah sesuai trayek pH indikator
3. Titrasi Asam Basa
Titrasi asam basa melibatkan asam maupun basa sebagai titrat maupun titran. Kadar larutan asam ditentukan dengan menggunakan larutan basa atau sebaliknya. Titran ditambahkan titrat tetes demi tetes sampai mencapai keadaan ekuivalen (titran dan titrat habis bereaksi) yang ditandai perubahan warna indikator. Keadaan ini disebut dengan titik ekuivalen, yaitu konsentrasi asam sama dengan konsentrasi basa. Sedangkan, keadaan dimana titrasi dihentikan dengan melihat perubahan warna indikator disebut titik akhir titrasi. Titik akhir titrasi ini mendekati titik ekuivalen, tapi biasanya titik akhir titrasi ini mendekati titik ekuivalen, tetapi biasanya titik akhir titrasi melewati titik ekuivalen. Oleh karena itu, titik akhir titrasi sering disebut juga titik ekuivalen (Adi Gunawan, 2004).
Percobaan ini dengan menyiapkan asam cuka 2 ml, kemudian dimasukkan ke dalam labu ukur 100 ml, lalu diencerkandenganm aquades ± 0,5 cm di bawah garis tanda batas. Disiapkan buret dengan membilas terlebih dahulu sebanyak 3 kali dengan NaOH 0,1 M. Selanjutnya buret diisi dengan larutan standar NaOH 0,1 M sampai ke ujung buret.asam cuka yang sudah diencerkan, dimasukkan ke dalam 25 ml Erlenmeyer, serta ditambahkan 1-3 tetes indikator PP. Titrasi larutan asam cuka hingga terjadi perubahan warna dan proses titrasi diulang tiga kali.
Hasil yang diharapkan dari percobaan ini adalah warna yang sesudah titrasi adalah pink seulas dan penitrasi sudah mencapai titik ekuivalen.
C. Alat dan Bahan
1. Penentuan Trayek pH Indikator Asam Basa
§ Alat
1. Tabung reaksi : 12 buah
2. Rak tabung reaksi : 1 buah
3. Gelas kimia 10 ml : 3 buah
4. Gelas ukur 10 ml : 1 buah
5. Pipet tetes : 13 buah
6. Lumpang dan alu : 1 buah
§ Bahan
1. Larutan pH dari pH 1 – 12 @7 ml
2. Indikator Metil Jingga (MO) 2 tetes
3. Indikator Metil Merah (MM) 2 tetes
4. Indikator Phenophthalein (PP) 2 tetes
5. Indikatol Bromtimol Biru (BTB) 2 tetes
6. Alkohol/aseton
7. Kembang sepatu
8. Kol merah
9. Kunir
10. Kertas saring / kapas
2 2. Penentuan pH Larutan
§ Alat
1. Tabung reaksi : 12 buah
2. Rak tabung reaksi : 1 buah
3. Pipet tetes : 10 buah
§ Bahan
1. Larutan HCl 0,1 M : 1 ml
2. Larutan H2SO4 0,1 M : 1 ml
3. Larutan Al2(SO4)3 0,1 M : 1 ml
4. Larutan NaCl 0,1 M : 1 ml
5. Larutan Ca(OH)2 0,1 M : 1 ml
6. Larutan NH4OH 0,1 M : 1 ml
7. Larutan Na2CO3 0,1 M : 1 ml
8. Larutan vinegar ( sari dari buah jeruk)
9. Kertas lakmus merah dan biru
10. Larutan indikator MO : 1 ml
11. Larutan indikator MM : 1 ml
12. Larutan indikator PP : 1 ml
13. Larutan indikator BTB : 1 ml
14. Ekstrak kembang sepatu : 1 ml
15. Ekstrak kol merah : 1 ml
16. Ekstrak kunir : 1 ml
3 3. Titrasi Asam Basa
§ Alat
1. Buret : 1 buah
2. Corong : 1 buah
3. pipet gondok 25 ml : 1 buah
4. Pipet gondok 5 ml : 1 buah
5. Labu ukur 100 ml : 1 buah
6. Pipet tetes : 1 buah
7. Erlenmeyer 250 ml : 3 buah
8. Gelas kimia : 1 buah
9. Statif, klem, dan manec : 1 set
10. Balon pipet : 1 buah
11. Botol semprot : 1 buah
§ Bahan
1.Larutan standar NaOH 0, 1 M : 150 ml
2.Larutan asam cuka sampel 5 ml : 5 ml
3.Indikator Phenolphthalein (PP) : 9 tetes
4.Aquades
5.Kertas saring
D. Material Safety Data Sheet (MSDS)
1. HCl
§ Sifat Fisik dan Kimia
1. Penampilan : Cairan
2. Bau : Pedas
3. Warna : Tak berwarna menyala kuning
4. pH : Asam
5. Tekanan uap : 16 kPa
6. Kelarutan : Larut dalam air dingin, panas, dietil eter
7. Korosivitas : Sangat korosif dihadapan alumunium, tembaga, stainlesss
stell, namun non korosif terhadap kaca.
§ Identifikasi Bahaya
sangat berbahaya jika terjadi kontak dengan kulit, kontak dengan mata, tertelan. Sedikit berbahaya jika tertelan (paru – paru sensitif). Kontak kulit dapat menghasilkan kerusakan jaringan terutama selaput lendir mata, mulut, dan alat pernapasan. Menghirup cairan dapat menghasilkan iritasi pada saluran pernapasan, paling parah dapat menyebabkan kematian.
§ Pertolongan Pertama
Mata : Periksa dan lepas lensa kontak. Basuh mata dengan air mineral 15 menit
Kulit : Melepaskan pakaian atau sepatu yang terkontaminasi. Segera basuh kulit
dengan banyak air
Terhirup : Segera pindah ke udara segar jika tidak dapat bernapas dapatkan
pernapasan segaera (nafas buatan)
Tertelan : Jangan memaksakan muntah kecuali diarahkan untuk memuntahkannya
oleh tenaga medis. Jangan masukkan apapun ke dalam mulut.
2. Natrium Hidroksida (NaOH)
§ Sifat Fisik dan kimia
1. Bentuk : solid/padat
2. Bau : berbau
3. Tampilan : pelet pipih
4. pH : 14 (basa)
5. Tekanan uap : 1 mmHg, 739
6. Titik didih : 760 mmHg, 139
7. Titik lebur : 318
8. Berat molekul : 40
§ Identifikasi Bahaya
Mata : Menyebabkan kebutaan dan kerusakan ‘pada kornea mata.
Kulit : Menyebabkan kulit terbakar, kontak kulit berulang menyebabkan
dermatitis.
Terhirup : Menyebablan iritasi pada saluran pernapasan.
Tertelan : Menyebabkan kerusakan pada saluran pencernaan.
§ Cara penanganan
Mata : Segera siram mata dengan air 15 menit dan segera ke dokter.
Kulit : Segera siram kulit dengan air 15 menit
Terhirup : Lepaskan ke udara segar, jika sulit bernapas beri oksigen dan dapatkan
bantuan medis.
Tertelan : Jangan dimuntahkan. Jangan berian apapun ketika keadaan tidak sadar,
dan segera dapatkan bantuan medis.
3. Asam Sulfat (H2SO4)
§ Sifat Fisik dan Kimia
1. Bentuk : Cair bening
2. Bau : Berbau
3. pH : Asam
4. Tekanan uap : 1 mmHg @145,8
5. Kelarutan dalam air : Dapat larut
6. Titik didih : 330
7. Titik lebur : -15
§ Identifikasi Bahaya
Dapat menyebabkan iritasi dan terbakar. Berbahaya jika teroles. Hindari uap ataupun asapnya. Hindari kontak dengan mata, kulit, ataupun baju. Gunakan dalam ventilasi cukup serta cuci tangan dengan bersih setelah memegang dan simpan rapat-rapat.
§ Cara Penanganan
Mata : Basuh mata dengan air 15 menit, buka tutup pelupuk mata beberapa
kali. Cari pertolongan medis.
Kulit : Bila terjadi kontak, segera basuh kulit dengan air 15 menit saat
membersikan pakaian dan sepatu yang terkontaminasi. Bersihkan secara
menyeluruh pakaian dan sepatu sebelum digunakan lagi.
Terhirup : Segera cari udara segar. Jika tidak dapat bernapas, berikan nafas buatan.
Tertelan : Berikan beberapa gelas susu dan air. Akan terjadi beberapa kali muntah,
jangan memasukan apapun ke dalam mulut orang yang tidak sadarkan diri.
4. Natrium Karbonat (Na2CO3)
§ Sifat Fisik dan Kimia
1. Bentuk : Solid
2. Tampilan : Putih
3. Bau : Tidak berbau
4. Titik didih : 400
5. Titik lebur : 851
6. Kelarutan : Laarut dalam air
7. Berat molekul : 105,9778
§ Identifikasi Bahaya
Mata : Menyebabkan cedera kornea. Kontak dengan mata dapat menyebabkan
iritasi parah, mata dan luka bakar.
Kulit : Kontak kulit dapat menyebabkan iritasi dan luka bakar, terutama jika
kulit basah atau lembab.
Tertelan : Dapat menyebabkan iritasi pada saluran pencernaan.
Terhirup : Dapat menyebabkan iritasi pada saluran pernapasan dengan nyeri
terbakar di hidung, tenggorokan, dan paru-paru.
§ Pertolongan Pertama
Mata : Segera siram mata dengan banyak air sedikitnya selama 15 menit,
sesekali mengangkat pelupuk mata atas dan bawah.
Kulit : Siram kulit dengan banyak air dan sabun 15 menit saat mengeluarkan
pakaian dan sepatu yang terkontaminasi.
Tertelan : Jangan memancing muntah. Jangan memberikan apapun melalui mulut
kepada orang yang tidak sadar. Dapatkan medis segera.
Terhirup : Lepaskan ke udara segar. Jika tidak dapat bernapas, berikan pernapasan
buatan. Jika sulit bernapas berikan oksigen.
E. Langkah Kerja
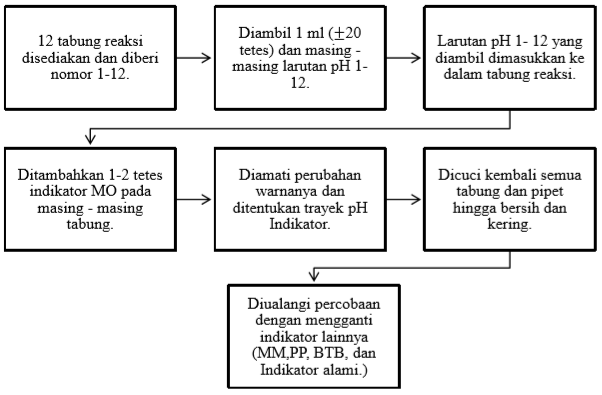
1. Penentuan Trayek pH Indikator Asam Basa
Cara membuat ekstrak dari beberapa indikator alami, seperti : kembang sepatu, kol merah, dan kunir.
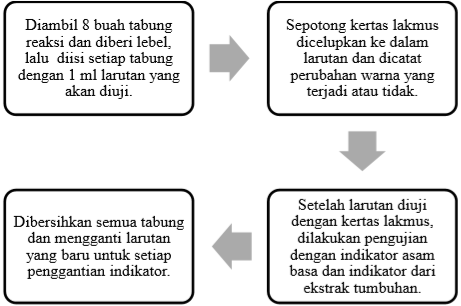
2. Penentuan pH Larutan
3. Titrasi Asam Basa
F. Data Pengamatan
1. Penentuan trayek pH larutan
2. Penentuan pH larutan
3. Titrasi asam basa
Volume CH3COOH (V2) = 25 mL
Konsentrasi NaOH (M1) = 0,1 M
Konsentrasi CH3COOH (M2) = ................M
Volume penitrasi (NaOH 0,1 M) yang dibutuhkan:
1. Angka awal pentitar = 0 mL
Angka akhir pentitar = 22,60 mL
Volume NaOH 0,1 M yang dibutuhkan:
= Angka akhir pentitar – Angka awal pentitar
= 22,60 mL
2. Angka awal pentitar = 0 mL
Angka akhir pentitar = 22,52 mL
Volume NaOH 0,1 M yang dibutuhkan:
= Angka akhir pentitar – Angka awal pentitar
= 22,52 mL
3. Angka awal pentitar = 0 mL
Angka akhir pentitar = 22,30 mL
Volume NaOH 0,1 M yang dibutuhkan:
= Angka akhir pentitar – Angka awal pentitar
= 22,30 mL
Volume NaOH 0,1 M rata-rata = 22,60 mL + 22,52 mL + 22,30mL
3
= 22,47 mL
Pengamatan warna larutan sebelum dan sesudah titrasi:
Warna larutan NaOH = tidak berwarna
Warna larutan CH3COOH = tidak berwarna
Warna larutan CH3COOH + Ind. PP = tidak berwarna
Warna larutan CH3COOH + Ind. PP + NaOH = pink seulas
Persamaan reaksi :
G. Perhitungan
1. Penentuan pH larutan
a. Larutan HCl 0,1 M

g. Larutan Na2CO3 O,1 M
\
2. Titrasi asam basa
a. Standarisasi NaOH Dengan H2C2O4 0,1 M
Dik : M H2C2O4 = 0,1M M NaOH = …?
V H2C2O4 = 10ml VNaOH = 10,73ml
n H2C2O4 = 2 nNaOH = 1
Dit : M NaOH = …?
Jawab :
M H2C2O4 × V H2C2O4 × n H2C2O4 = M NaOH × V NaOH × nNaOH
0,1M × 10ml × 2 = M NaOH × 10,73ml × 1

b. Titrasi asam cuka makan dengan NaOH
Dik : M CH3COOH = ….? M NaOH = 0,186M
V CH3COOH = 25ml VNaOH = 22,47ml
n CH3COOH = 1 nNaOH = 1
Dit : M CH3COOH = ….?
Jawab :
M CH3COOH × V CH3COOH × nCH3COOH = M NaOH × V NaOH × nNaOH
M CH3COOH × 25ml × 1 = 0,186M × 22,47ml × 1
c. Konsentrasi cuka makan sebelum pengenceran
Dik : M sebelum = ….? M sesudah = 0,17M
V sebelum = 5ml V sesudah = 100ml
Dit : M sebelum = ….?
Jawab :
M sebelum × V sebelum = M sesudah × V sesudah
M sebelum × 5ml = 0,17M × 100ml
d. Massa asam asetat pada cuka makan

e. Kadar asam asetat dalam cuka makan
H. Analisis Data
1. Penentuan Trayek pH Indikator Asam Basa
1. Penentuan pH larutan
a. Larutan HCl 0,1 M
b. Larutan H2SO4 0,1 M
c. Larutan Al2(SO4)3 0,1 M

d. Larutan NaCl 0,1 M
NaCl berasal dari asam kuat (HCl) dan basa kuat (NaOH), karena reaksi ini asam kuat dan basa kuat, maka tidak dapat terhidrolisis, sehingga pH NaCl = 7 dan bersifat netral.
e. Larutan Ca(OH)2 0,1 M
f. Larutan NH4OH 0,1 M
Jadi, pH larutan NH4OH adalah 11,13
\

2. Titrasi asam basa
a. Standarisasi NaOH Dengan H2C2O4 0,1 M
Dik : M H2C2O4 = 0,1M M NaOH = …?
V H2C2O4 = 10ml VNaOH = 10,73ml
n H2C2O4 = 2 nNaOH = 1
Dit : M NaOH = …?
Jawab :
M H2C2O4 × V H2C2O4 × n H2C2O4 = M NaOH × V NaOH × nNaOH
0,1M × 10ml × 2 = M NaOH × 10,73ml × 1
b. Titrasi asam cuka makan dengan NaOH
Dik : M CH3COOH = ….? M NaOH = 0,186M
V CH3COOH = 25ml VNaOH = 22,47ml
n CH3COOH = 1 nNaOH = 1
Dit : M CH3COOH = ….?
Jawab :
M CH3COOH × V CH3COOH × nCH3COOH = M NaOH × V NaOH × nNaOH
M CH3COOH × 25ml × 1 = 0,186M × 22,47ml × 1
c. Konsentrasi cuka makan sebelum pengenceran
Dik : M sebelum = ….? M sesudah = 0,17M
V sebelum = 5ml V sesudah = 100ml
Dit : M sebelum = ….?
Jawab :
M sebelum × V sebelum = M sesudah × V sesudah
M sebelum × 5ml = 0,17M × 100ml
d. Massa asam asetat pada cuka makan

e. Kadar asam asetat dalam cuka makan

H. Analisis Data
1. Penentuan Trayek pH Indikator Asam Basa
Pada praktikum pertama ini, dilakukan percobaan penentuan trayek pH untuk indikator asam basa yang bertujuan untuk menentukan trayek pH berbagai indikator asam basa, yaitu indikator alami maupun indikator buatan. Indikator alami yang digunakan yaitu kembang sepatu, kol merah, dan kunir. Sedangkan, indikator buatannya adalah MM, MO, PP, dan BTB. Bahan atau larutan yang diuji adalah larutan dengan pH 1-12.
a. Metil Jingga (MO)
Indikator metal jingga (MO) ini memiliki rumus C14H14N3NaO3S. Indikator MO ini mempunyai trayek pH 3,1-4,4 yaitu dengan perubahan warna, jika asam=jingga dan basa = kuning. Dalam percobaan kali ini dengan langkah meneteskan 10 tetes pH 1-2 pada masing-masing tabung reaksi, kemudian diteteskan 2-3 tetes indikator metil jingga (MO). Pada larutan pH 3 berwana merah muda, pH 4 berwarna jingga, dan larutan pH 5-12 terjadi perubahan warna dari tidak berwarna menjadi kuning. Pada percobaan berarti memiliki trayek pH 3-5 karena terjadi perubahan warna mulai yang sangat spesifik dari pH 3-5. Namun, menurut teori indikator MO mempunyai trayek pH 3,1-4,4. Hal ini terjadi perbedaan antara percobaan dan teori, kerana kemungkinan disebabkan larutan pH 1-12 yang sudah terkontaminasi dan tidak bersihnya dalam pencucian tabung reaksi yang masih meninggalkan zat sisa pada praktikum sebelumnya.
b. Phenolpthalein (PP)
Indikator ini sering disebut sebagai indikator basa karena indikator PP mempunyai trayek pH 8,3-10 dengan perubahan warna, jika asam = tidak berwarna, sedangkan basa=merah keunguan. Indikator PP ini merupakan senyawa organik dengan rumus C20H14O4, yang mudah larut dalam air. Dari hasil percobaan didapat hasil dari pH 1-8 tidak terjadi perubahan warna yaitu tetap tidak berwarna, sedangkan pada larutan pH 9 perubahan warna menjadi merah muda, dan pada pH 10-12 terjadi perubahan warna menjadi ungu. Dari hasil percobaan indikator ini memiliki trayek pH 8-10 sesuai dengan perubahan warna yang spesifik. Dari percobaan dan teori hampir sama, tetapi untuk mengetahui desimal lebih detailnya yang belum diketahui.
c. Metil merah(MM)
Indikator metil merah (MM) ini memiliki rumus C15H15N3O2. Dalam percobaan ini larutan pH 1-12 diteteskan 10 tetes pada tabung reaksi, lalu ditetesi indikator MM dan terjadi perubahan warna. Pada larutan pH 1-4 dari yang mulanya tidak berwarna menjadi berwana merah. Pada larutan pH 5 terjadi perubahan warna menjadi merah muda. Lalu pada pH 6-12 terjadi perubahan menjadi kuning. Perubahan warna larutan yang terjadi ini disebabkan karena indikator MM mempunyai trayek pH tertentu. Dari hasil percobaan perubahan warna yang spesifik yaitu pada perubahan warna dari pH 4-6. Menurut (Sudarmo, 2013), Indikator MM memiliki trayek pH antara 4,4-6,2 dan perubahan warna yang terjadi, jika asam=merah dan basa=kuning. Pada percobaan ini hasilnya hampir sama dengan teori. Kesalahan dapat terjadi dalam meneteskan indikator metil merah ataupun tidak kering dan bersihnya tabung reaksi yang digunakan.
d. BTB
Indikator Bromtimol Biru(BTB) ini mempunyai rumus C14H14NaO3S, yang juga merupakan senyawa organik. Menurut teori, indikator ini mempunyai trayek pH 6,0-7,3 dengan kondisi asam berwarna kuning dan kondisi basa berwarna biru. Namun dari hasil percobaan pada pH 1-5 memiliki warna kuning, lalu pada larutan pH 6-7 memiliki warna hijau, dan pada larutan pH 8-12 berwarna biru. Pada percobaan yang didapat diambil trayek pH 5-8 karena perubahan warna yang spesifik terjadi diantara pH tersebut. Pada hal tersebut berbeda dengan teori karena pada teori bertrayek pH 6,0-7,6. Perbedaan ini bisa terjadi karena kesalahan dalam kurang bersihnya dalam mencuci tabung reaksi dan ketidaktelitian.
e. Ekstrak kembang sepatu
Pada kembang sepatu mengandung pigmen antosianin yang memberikan perubahan warna pada senyawa asam maupun senyawa basa. Oleh karena itu ekstrak kembang sepatu dapat dijadikan sebagai indikator. Dalam suasana asam akan menunjukkan warna merah dan kondisi basa akan menunjukkan warna hijau. Pada percobaan kembang sepatu ini dibuat dahulu ekstrak dengan cara mengambil 5 gram kembang sepatu, lalu ditumbuk dengan alu dan lumpang hingga alus. Lalu dimasukkan 10 ml alkohol ke dalam gelas kimia dengan ekstrak kembang sepatu didiamkan beberapa saat lalu dituangkan ke dalam gelas ukur dengan ditutup oleh kertas alumunium foil. Terdapatnya indikator alkohol atau etanol digunakan karena alkohol mempunyai pelarut organik yang baik. Dari hasil percobaan diperoleh dari rentang pH 1-6 berwarna merah, lalu pH 7 tidak berwarna, pada larutan pH 8 berwarna hijau, serta larutan pH 9-10 coklat dan 11-12 berwarna ungu. Menurut teori bahwa indikator alami tidak memiliki trayek pH yang spesifik namun hanya bisa menentukan sifat asam atau basanya karena saat berwarna merah yaitu asam dan saat berwarna hijau yaitu basa. Dari hasil percobaan ditentukan bawa trayek pH kembang sepatu ini adalah 4-11 karena perubahan warna yang spesifik terjadi pada rentang larutan dengan pH 4-11.
f. Kol merah
Kol atau kubis merah ini mengandung banyak vitamin juga mengandung zat antosianin yang mampu mengubah warna kubis atau kol menjadi merah. Kubis merah mengandung setidaknya 36 dari 300 macam antosianin yang berperan dalam berbagai warna merah dan biru pada tanaman. Bahan asam ditandai dengan memiliki lebih banyak atom (H+) dari kelompok hidroksil (OH-) sehingga ketika terkena asam, antosianin merebut atom hidrogen dan berubah menjadi merah. Dalam keadaan basa dimana tidak ada kelebihan hidrogen atom, molekul warna yang muncul adalah biru atau hijau.
Dari hasil percobaan diperoleh hasil saat pH 1-4 mengalami perubahan menjadi warna merah, larutan pH 5-7 warna ungu, dan pada larutan pH 8-12 berwarna hijau. Kol merah juga tidak mempunyai trayek pH, sehingga dari hasil percobaan didapatkan trayek pH 4-8 karena perubahan warna spesifik terjadi pada saat trayek pH 4-8.
g. Kunir atau kunyit
Ekstrak kunyit digunakan sebagai indikator asam basa dengan memanfaatkan timpang yang dibuat ekstrak. Larutan ekstraknya ini berwarna kuning pekat jika pada asam akan berwarna kuning dan pada basa berwarna merah. Berdasarkan percobaan ditentukan adalah pH 8-9 karena yang mengalami perubahan warna spesifik dari kuning menjadi merah. Ekstrak kunyit tidak memiliki trayek pH sendiri.
2. Penentuan pH larutan
Pada percobaan ini menggunakan delapan jenis larutan dengan pH yang berbeda-beda tentunya. Larutan yang digunakan adalah HCl, H2SO4, Al2(SO4)3, NaCl, Ca(OH)2, NH4OH, Na2CO3, dan vinegar. Pada percobaan ini bertujuan untuk menentukan pH larutan dengan menggunakan indikator asam basa baik alami maupun buatan.
a. HCl 0,1 M
Dari hasil percobaan yang dilakukan, didapati hasil yang ditetesi oleh indikator:
Ekstrak
§ Kembang sepatu : jingga pekat
§ Kol merah : jingga pekat
§ Kunir : jingga
Indikator
§ MO : merah pekat
§ PP : tidak berwarna
§ MM : merah muda(pink)
§ BTB : jingga
Dari hasil perhitungan teoritis didapat pH HCl 0,1 M adalah pH HCl=1, namun dari hasil percobaan didapat pH HCl <3. Sifat asam mempunyai pH≤7. Seperti halnya HCl yang merupakan asam kuat. Perbedaan dari perhitungan dengan percobaan tidak terlalu jauh, hal ini dapat terjadi karena HClnya sudah tidak murni lagi karena terkontaminasi oleh udara, sama halnya dengan indikator juga bisa terjadi seperti itu, dan tidak sama tetesan indikatornya. Dibuktikan juga dari kertas lakmus biru yang merubah menjadi merah dan lakmus merah tetap berwarna merah. Hal ini menunjukkan bahwa HCl bersifat asam.
b. H2SO4 0,1 M
Dari hasil percobaan yang dilakukan H2SO4 0,1 M ditetesi oleh:
Ekstrak
§ Kembang sepatu : jingga pekat
§ Kol merah : jingga pekat
§ Kunir : jingga muda
Indikator
§ MO : merah pekat
§ PP : tidak berwarna
§ MM : merah muda(pink)
§ BTB : jingga
Dari hasil perhitungan teoritis didapat 0,7. Namun dari hasil percobaan didapat pH larutan H2SO4 0,1 M yaitu sebesar pH<3. Hal ini terjadi karena hal yang sama seperti pada HCl yaitu faktor kecerobohan karena tidak segera meneteskan indikator dan larutannya, karena sudah terkena udara dan dari kurang bersihnya plat tetes yang dicuci. H2SO4 0,1 M saat diberikan lakmus biru berubah menjadi merah, pada lakmus merah tidak mengalami perubahan warna. Menunjukkan H2SO4 0,1 M bersifat asam.
c. Al2(SO4)3 0,1 M
Berdasarkan percobaan yang ditetesi oleh:
Ekstrak
§ Kembang sepatu : ungu pekat
§ Kol merah : ungu
§ Kunir : jingga
Indikator
§ MO : merah
§ PP : tidak berwarna
§ MM : merah muda(pink) pekat
§ BTB : kuning
Pada percobaan ini didapati warna larutan pH Al2(SO4)3 adalah <3, sedangkan dari hasil perhitungan yaitu 3,2. Hal ini terjadi perbedaan warna pH karena kemungkinan selain dari ketidaktelitian praktikan dalam membaca warna, meneteskan indikator, dan mencuci plat tetes yang tidak bersih, juga bisa terjadi karena penggunaan nilai kb yang berbeda-beda. Dalam hal ini Al2(SO4)3 merupakan garam bersifat asam karena berasal dari asam kuat (H2SO4)dengan basa lemah Al(OH)3. Dari hasil pengamatan lakmus merah yang tidak berubah warna, namun lakmus biru yang berubah menjadi warna merah, hal ini membuktikan bahwa Al2(SO4)3 bersifat asam.
d. NaCl 0,1 M
NaCl merupakan garam yang bersifat netral karena berasal dari NaOH (basa kuat) dan HCl (asam kuat) yang jika keduanya bereaksi tidak mengalami hidrolisis sehingga hasilnya garam netral dengan pH =7. Dari percobaan didapat 4<pH<5 hal ini berbeda karena factor ketidaktelitian dan ketidakhati-hatian praktikan dalam menjaga larutan agar tidak terjadi karena kotoran dari udara. NaCl yang ditetesi dengan hasil percobaan:
Hasil percobaan :
Ekstrak
§ Kembang sepatu : ungu seulas
§ Kol merah : ungu seulas
§ Kunir : kuning
Indikator
§ MO : jingga
§ PP : tidak berwarna
§ MM : jingga seulas
§ BTB : jingga
Lakmus merah dan biru tidak mengalami perubahan saat dicelupkan dalam NaCl.
e. Ca(OH)2 0,1 M
Dari hasil perhitungan bahwa Ca(OH)2 didapat pH Ca(OH)2 adalah 13,3. Hal ini mengindikasikan bahwa Ca(OH)2 ini bersifat basa yaitu basa kuat. Dibuktikan saat praktikum yaitu saat lakmus biru tidak mengalami perubahan warna, namun lakmus merah mengalami perubahan warna menjadi biru dan dari percobaan didapat pH>11. Dan pada saat percobaan Ca(OH)2 ditetesi oleh:
Ekstrak
§ Kembang sepatu : hijau tua
§ Kol merah : hijau tosca
§ Kunir : jingga
Indikator
§ MO : jingga seulas
§ PP : ungu muda
§ MM : kuning
§ BTB : biru tua
f. NH4OH 0,1 M
NH4OH saat ditetesi oleh:
Ekstrak
§ Kembang sepatu : ungu kehitaman
§ Kol merah : hijau muda
§ Kunir : jingga
Indikator
§ MO : jingga seulas
§ PP : ungu muda
§ MM : kuning muda
§ BTB : biru tua
Dari hasil perhitungan didapat pH NH4OH adalah sebesar 11,13 hal ini mengindikasikan bahwa NH4OH bersifat basa lemah. Di dukung dari hasil percobaan dengan kertas lakmus biru yang tetap berwarna biru dan lakmus merah yang berubah warna menjadi biru. Dari percobaan warna diperoleh bahwa NH4OH itu pHnya > 11, hal ini hampir serupa dengan pH dari hasil perhitungan.
g. Na2CO3 0,1 M
Percobaan ditetesinya larutan Na2CO3 0,1 M dengan:
Ekstrak
§ Kembang sepatu : ungu kehitaman
§ Kol merah : hijau muda
§ Kunir : jingga
Indikator
§ MO : jingga
§ PP : ungu
§ MM : kuning seulas
§ BTB : biru tua
Dari perhitungan didapat pH Na2CO3 adalah 9,68, namun saat dilakukan percobaan dilihat dan hasil warna larutan didapat pH Na2CO3 >11. Perbedaan ini dikarenakan pada perhitungan menggunakan Ka yang berbeda-beda. Na2CO3 merupakan senyawa dari basa kuat NaOH dengan asam lemah H2CO3 yang mengalami hidrolisis menjadi garam basa. Hal ini dibuktikan juga dengan kertas lakmus merah yang berubah menjadi biru dan lakmus biru tetap biru.
h. Vinegar
Vinegar dari hasil percobaan:
Ekstrak
§ Kembang sepatu : jingga seulas
§ Kol merah : merah muda
§ Kunir : kuning
Indikator
§ MO : jingga pekat
§ PP : kuning
§ MM : merah muda
§ BTB : jingga
Pada larutan vinegar ini perubahan warna terjadi pada pH<4. Larutan vinegar ini adalah larutan yang bersifat asam. Dengan kertas lakmus pun dapat memerahkan lakmus biru. Namun kertas lakmus merah tetap berwarna merah.
3. Titrasi asam basa
Pada percobaan titrasi ini bertujuan untuk mengetahui, menentukan konsentrasi larutan asam (CH3COOH) dengan larutan basa standar (NaOH). Bahan yang digunakan adalah basa kuat (NaOH) dan asam lemah CH3COOH dengan persamaan reaksi:
Pada percobaan ini digunakan NaOH, dimana sifat dari NaOH adalah bigroskopis artinya konsentrasi NaOH mudah berubah-ubah jika dibiarkan dalam udara terbuka, NaOH mudah untuk menyerap molekul air dari lingkungannya. Larutan standar primer yaitu larutan oksalat. Hal ini bertujuan untuk menentukan konsentrasi NaOH secara tepat, larutan NaOH yang termasuk larutan higroskopis karena mudah bereaksi dengan udara jika larutan NaOH terbuka terus-menerus lama-kelamaan larutan NaOH akan habis. Proses standarisasi ini bertujuan untuk mengetahui konsentrasi NaOH secara tepat yang didapatkan sekitar 0,186M. Maka, NaOH yang konsentrasinya 0,186 M digunakan sebagai titran untuk proses titrasi dengan asam asetat. Persamaan reaksi pada proses standarisasi larutan NaOH dengan asam oksalat :
Dengan langkah awal menyiapkan buret yang sudah dibersihkan dahulu lalu, dimasukkan NaOH ke dalam buret hingga batas nol. Di mulailah diambil sampel CH3COOH sebanyak 2ml dengan pipet gondok lalu dituangkan dalam labu bulat dan diencerkan dengan aquades hingga 100 ml batas labu bulat lalu ditutup dan dikocok hingga merata dan CH3COOH sudah encer. Lalu ditambahkan indikator PP ke dalam erlenmeyer sebanyak 25 ml dan dilakukan percobaan tiga kali dengan langkah yang sama. Pada saat indikator PP sudah ditambahkan ke dalam erlenmeyer dimulailah proses titrasi dengan perlahan.
Pada percobaan pertama didapat volume NaOH=22,60 ml dengan perubahan warna menjadi pink seulas. Pada percobaan kedua didapat volume NaOH= 22,52 ml dan percobaan ketiga volume NaOH=22,30 ml masing-masing dengan warna pink seulas. Dengan rata-rata volume NaOH= 22,47 ml. Pada saat berwarna pink seulas inilah disebut titik akhir titrasi. Titran ini dilakukan tiga kali percobaan. Di dapat konsentrasi CH3COOH sesudah pengenceran sebesar 0,17 M dan sebelum pengenceran sebesar 3,4 M dan saat menghitung kadar asam cuka dagang diperoleh 20,4% . Hasil kadar asam cuka dagang yang diperoleh tidak sesuai dengan asam cuka dagang yang digunakan titrasi yaitu 25% disebabkan oleh beberapa faktor yaitu kurang tepatnya membaca angka volume pada buret, asam cuka yang sudah lama beredar, dan kurang tepatnya saat mengukur atau mengambil larutan.
J. Pertanyaan Akhir
Tentukan konsentrasi asam cuka sebelum diencerkan
Dik : % massa = 25%
Massa molar = 60,05 g/mol
Massa jenis = 0,996 g/ml
Dit : M ?
Jawab :
K. Kesimpulan
1. Dari percobaan didapat trayek pH indicator asam basa:
Indikator MM : 4-6
Indikator MO : 3-5
Indikator PP : 8-10
Indikator BTB : 5-8
Ekstrak kembang sepatu : 4-11
Ekstrak kol merah : 4-8
Ekstrak kunir/kunyit : 8-9
2. Dari perubahan warna pada pH indikator asam basa:
3. pH larutan berdasarkan (dalam 0,1 M)
4. Larutan NaCl bersifat netral karena berasal dari asam kuat (HCl) dan basa kuat (NaOH).
5. Larutan HCl, H2SO4, Al2(SO4)3, dan vinegar bersifat asam.
6. Larutan Ca(OH)2, NH4OH, Na2CO3 bersifat basa.
7. Persamaan reaksi pada proses standarisasi larutan NaOH dengan asam oksalat :
8. Konsentrasi NaOH setelah standarisasi didapatkan sebesar 0,186 M.
9. Volume NaOH yang digunakan pada proses titrasi yaitu:
V NaOH1 = 22,60 mL
V NaOH2 = 22,52 ml
V NaOH3 = 22,30 ml
V rata rata NaOH = 22,47 ml
10. Pada percobaan, konsentrasi asam cuka setelah pengenceran adalah 0,17 M.
11. Pada percobaan, konsentrasi asam cuka sebelum pengenceran adalah 3,4 M.
12. Kadar CH3COOH yang terkandung dalam asam cuka makan adalah 20,4%
13. Persamaan reaksi titrasi pada percobaan yaitu
L. Daftar Pustaka
Cita, Indira. 2015. Pembuatan Indikator Asam-Basa Karamunting. Jurnal. Vol XI (Nomor 1).
Fhany, dkk. “Pengembangan Media Pembelajaran Indikator Asam Basa Alami Berbasis Bioselulosa”. Jurnal Ar-Razi Ilmiah, volume 7, no. 1, februari 2019, ISSN. 2503-4448.
Gunawan, Adi, Roeswati. 2004. Tangkas Kimia. Surabaya: Kartika.
Nuryanti, S., Matsjeh, S., Anwar, C. & Raharjo, T. J. 2010. Indikator titrasi asam-basa dari
ekstrak bunga sepatu (hibiscus rosa sinensisl). Jurnal AGRITECH, 30(3), 178-183.
Safitri, dkk. 2019. Pembuatan Kertas Indikator Alami sebagai Alat Praktikum Penentuan Sifat Asam dan Basa suatu larutan. Jurnal Untan.
Safitri, dkk. 2019. Pembuatan Kertas Indikator Alami sebagai Alat Praktikum Penentuan Sifat Asam dan Basa suatu larutan. Jurnal Untan.
M. Lampiran
1. Penentuan trayek pH
2. Penenetuan pH larutan